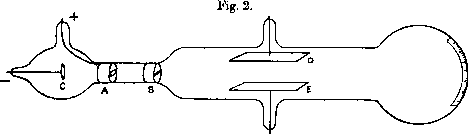
Un pennello di raggi catodici emesso dal catodo C e focalizzato in A e B passa tra gli elettrodi D ed E fra cui esiste un campo elettrico. Un campo magnetico viene creato da bobine esterne al tubo ed è perpendicolare al campo elettrico.
Il contesto scientifico
Da: Emilio Segrè, Personaggi e scoperte della fisica contemporanea. Da Rutherford ai quark, 1996, Mondadori
"I chimici naturalmente sapevano per lo meno dal 1804, data dei
lavori di J. Dalton, che gli atomi esistevano, ma questa opinione non era universalmente
condivisa. Si sarebbe portati a credere che la semplice esistenza delle leggi che
permettono di scrivere le formule chimiche, quella cioè di Prout delle proporzioni
definite e multiple, la regola di Avogadro che dice che volumi eguali di gas alla stessa
temperatura e pressione contengono lo stesso numero di molecole e le leggi
dell'elettrolisi di Faraday dovessero bastare a convincere chiunque dell'esistenza degli
atomi. Non era così e non solo nel 1895, ma fino al 1905 e forse anche un po' più tardi
c'erano ancora degli scettici, certamente né fissati né incompetenti. Il 'Waynflete
professor' di chimica a Oxford, B. C. Brodie (1817 - 1880), che occupava una delle più
prestigiose cattedre inglesi, non credeva negli atomi e scrisse libri per dimostrare che
l'ipotesi atomica non era necessaria. Egli si adirò fortemente quando apparvero modelli
molecolari con palline e bastoncini. Ernst Mach, insigne fisico e filosofo, non credeva
negli atomi e seguitò a dubitare anche quando vide le scintillazioni prodotte dalle
particelle a emesse dalle sostanze radioattive. Wilhelm Ostwald, un importante chimico
tedesco e uno dei primi vincitori del premio Nobel per la chimica, è un altro esempio.
Egli aveva sviluppato una nebulosa teoria dell'energetica che credeva potesse servire
anche per evitare gli atomi. Alla base di questo scetticismo non era tanto uno spirito di
contraddizione quanto il fatto che nessuno aveva visto un atomo, e anche oggi nessuno li
ha visti nel senso ordinario del verbo vedere, per quanto le prove della loro esistenza
siano assai più convincenti di quelle dell'esistenza di oggetti o fenomeni veduti da
molti, come certi miracoli o dischi volanti.
[...]
Partiamo dalle esperienze di Faraday sulla scarica dei gas rarefatti. Fin dal 1838 egli
aveva osservato degli effetti curiosi, striature, strati, spazi oscuri, pur senza poterci
capire molto, il che sarebbe stato impossibile a quei tempi. Nel 1858 J. Plücker, un
matematico e famoso topologo tedesco, ma anche fisico, ebbe un'idea geniale: avvicinare un
magnete alla scarica e osservarne gli effetti. Non vide un gran che perché il vuoto era
troppo cattivo, ma l'idea era buona. Nel 1869 J. W. Hittfort (1824 - 1914) vuotò i tubi
un po' meglio e cominciò a vedere quelli che oggi si chiamano raggi catodici. Si sa oggi
che esse sono elettroni, ma allora nessuno aveva l'idea dell'elettrone; tutto quello che
si sapeva era che i raggi partivano dall'elettrodo negativo o catodo e che urtando la
parete opposta del tubo la rendevano fluorescente.
Sorse allora una gran disputa sulla natura dei raggi catodici. Che cosa erano? Sembrava
viaggiassero in linea retta e una croce metallica interposta tra il catodo e l'anodo del
tubo proiettava la sua ombra. Forse erano deviati da un campo magnetico, per quanto le
opinioni in materia differissero a causa del pessimo vuoto con cui si facevano gli
esperimenti. Forse erano corpuscoli proiettati dal catodo. Stranamente le opinioni erano
divise a seconda della nazionalità: Hertz aveva detto nel 1883 che i raggi catodici non
erano particelle, ma una radiazione di qualche nuova specie. G. H. Wiedemann (1832 -
1919), E. Goldstein (1850 - 1930) e tutti i tedeschi fecero coro. In Inghilterra invece W.
Crookes (1832 - 1919) andava sostenendo che fossero particelle cariche elettricamente e
tutti gli inglesi fecero coro. Lord Kelvin, J. J. Thomson e altri sentenziarono:
particelle cariche. La ragione dell'incertezza è ora chiara. Crookes scrive in un lavoro
di aver ottenuto un vuoto straordinariamente buono. Questo vuoto corrispondeva ad una
pressione di 40 millesimi di millimetro di mercurio, un vuoto incredibilmente cattivo (e
Dio sa poi come Crookes lo misurava). Con vuoti così cattivi tutti i fenomeni si
complicano immensamente per la presenza di effetti secondari e diventano di difficilissima
interpretazione. In ogni modo J. J. Thomson e Crookes seguitarono ad investigare i raggi
catodici, finché Jean Perrin in Francia nel 1895 fece il passo decisivo. Essendo riuscito
finalmente a ottenere un vuoto adeguato poté raccogliere i raggi in una gabbia di Faraday
e dimostrare che trasportavano una carica. Mostrò anche che potevano essere deflessi da
un campo magnetico e, guidati da esso, potevano essere condotti dentro o fuori della
gabbia di Faraday.
Il nome di elettrone era già stato coniato da G. Johnstone Stoney nel 1894 e si aveva
l'idea che negli atomi ci fossero delle cariche elettriche che con il loro moto
producevano la luce. Anche altri fenomeni si spiegavano bene assumendo cariche elettriche
elementari più o meno puntiformi, ma le idee in proposito erano certo vaghe, quando
improvvisamente nel 1896 si fece un importante progresso. Esso era dovuto a Pieter Zeeman,
un giovane allora sconosciuto, che scoprì un nuovo fenomeno e al già famoso H. A.
Lorentz che ne dette subito l'interpretazione teorica. [...] Lorentz e Zeeman
determinarono e/m, la carica specifica, e il suo segno negativo.
[...]
Indipendentemente J. J. Thomson, a Cambridge, in una serie di classiche esperienze nel
1897 misurò il rapporto tra la carica e la massa dell'elettrone libero.
Gli elettroni di un fascio di raggi catodici sottoposti ad un campo elettrico E
sono soggetti a una forza
FE = e E
(dove e è la carica dell'elettrone, considerata con il suo segno) diretta come
il campo elettrico; sottoposti a un campo magnetico B sono soggetti ad
una forza
FB = (e/c) v
× B
dove B è il campo magnetico, v la
velocità dell'elettrone, c la velocità della luce. Il prodotto vettoriale v
× B è un vettore perpendicolare a v
e a B, di modulo B v sent (dove t è
l'angolo compreso tra v e B) e diretto
in modo che v, B e v
× B formino una terna come il pollice, l'indice e il medio
della mano destra.
Ognuna di queste forze produce una deviazione secondo la legge di Newton
F = FE + FB
= m a
dove m e a sono rispettivamente la massa e
l'accelerazione della particella. Si noti che se E, B,
v sono perpendicolari l'uno all'altro e se inoltre
E / B = v / c
la forza a cui è soggetta la particella si annulla ed essa si muove di moto uniforme e
rettilineo. Ne segue che in un dispositivo di campi elettrici e magnetici perpendicolari
tra di loro e a un fascio di particelle, solo le particelle di una certa velocità non
sono deflesse, le altre lo sono e abbandonano il fascio. Un dispositivo siffatto serve
quindi ad avere particelle della stessa velocità, nota, una volta che si conoscono E
e B.

Un pennello di raggi catodici emesso dal catodo C e focalizzato in A e B passa tra
gli elettrodi D ed E fra cui esiste un campo elettrico. Un campo magnetico viene creato da
bobine esterne al tubo ed è perpendicolare al campo elettrico.
Se ora si manda lo stesso fascio di velocità nota in un campo magnetico
uniforme B perpendicolare alla velocità, esso è deflesso e soggetto sia
alla forza FB che alla forza centrifuga mv2/r.
Le particelle muovono allora su un'orbita circolare di raggio r tale che le due
forze si fanno equilibrio, ossia tale che: Bev/c = mv2/r.
Poiché v è noto si può ricavare e / m che è uguale a cv/Br.
Un altro modo di operare misura la carica Q trasportata da N corpuscoli
Q = N e.
Gli stessi corpuscoli portano l'energia cinetica
W = (1/2)Nmv2
che può misurarsi calorimetricamente. Il rapporto W/Q = mv2/2e
dà anche e / m una volta noto v.
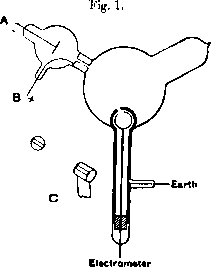
Gli elettrodi generati dal catodo A
possono essere deviati da un magnete esterno
e portati nel pozzo di Faraday,
dove se ne misura la carica totale.
Gli esperimenti di J. J. Thomson sfruttavano parecchi di questi metodi con
risultati concordanti, sebbene abbastanza grossolani. Essi dettero e/m =
6,6 x 1017 ues/g.
Al giorno d'oggi e/m è conosciuto con una precisione di circa 6 parti
per milione e si sa che vale 5,272764 x 1017 ues/g."

Schema e fotografia di uno dei tubi a raggi catodici usati da Thomson per i suoi
esperimenti
